Отрезанная конечность у тритона начинает восстанавливаться только в том случае, если в культе остался живой нерв. Механизм, посредством которого нерв «руководит» регенерацией, оставался неизвестным. Британские ученые обнаружили белок, играющий ключевую роль в этом механизме. Достаточно заставить клетки культи производить этот белок, чтобы конечность полностью восстановилась даже в отсутствие живых нервов.
|
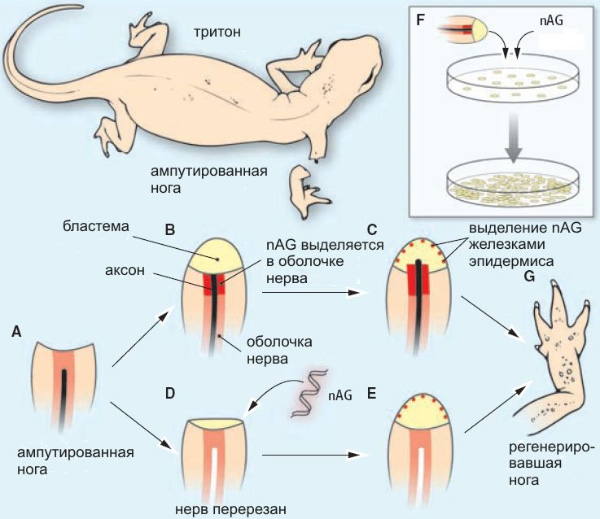
На месте ампутации у тритона сначала образуется так называемая бластема — «холмик» из стволовых клеток, из которого, если всё пойдет нормально, постепенно вырастет новая нога. Бластема образуется даже в отсутствие нерва, но тогда процесс регенерации на этом и останавливается. Если же в культе есть живой нерв (который тоже начинает регенерировать после ампутации), клетки бластемы активно делятся и постепенно формируют заново утраченные части ноги — начиная от проксимальных (ближайших к основанию) и кончая дистальными, то есть пальцами. Интересно, что нерв является необходимым условием только для ранних этапов регенерации (кроме самого раннего — образования бластемы); если конечность уже начала отрастать, то удаление нерва не останавливает этот процесс.
Регенерация конечности идет под управлением нескольких регуляторных белков и белковых комплексов, которые руководят также и процессом образования конечностей в онтогенезе (индивидуальном развитии). «Генетическая программа» регенерации, судя по всему, представляет собой слегка модифицированный фрагмент программы индивидуального развития, которая есть у всех животных (см.: Разгадан механизм регенерации конечностей, «Элементы», 27.11.2006).
Один из важных регуляторов развития конечности — белок Prod 1, располагающийся на поверхности клеток бластемы. Он задает проксимально-дистальный градиент, от которого зависит, какие части растущего зачатка станут плечом, какие предплечьем, а какие — кистью. Чем ближе к основанию конечности, тем выше концентрация белка Prod 1, чем дальше от основания — тем меньше молекул белка можно найти на поверхности клеток развивающегося зачатка. Экспериментально было показано, что если искусственно активизировать синтез белка Prod 1 в дистальной части зачатка, то там, где следовало бы появиться предплечью или кисти, развивается что-то плечеподобное, то есть клетки начинают вести себя так, как если бы они были расположены гораздо ближе к основанию конечности.
Британские биологи предположили, что белок Prod 1, располагающийся на поверхности клеток, играет роль рецептора, и, следовательно, должен существовать лиганд — вещество, которое связывается с этим рецептором (и таким образом клетки бластемы принимают извне некий руководящий сигнал). Этот гипотетический лиганд, очевидно, должен играть важную роль в регуляции регенерационных процессов. Оставалось его найти.
С этой целью ученые исследовали различные вещества, выделяемые клетками регенерирующей конечности, проверяя, не проявляют ли они склонности образовывать прочные комплексы с белком Prod 1. Целенаправленный поиск оказался успешным. Оказалось, что один из секретируемых (выделяемых клетками во внешнюю среду) белков, получивший название nAG, обладает искомым свойством. Этот белок относится к семейству белков AG (anterior gradient), о функциях которого известно довольно мало (в частности, известно, что некоторые AG-белки активно синтезируются в раковых опухолях у человека и грызунов).
Теперь нужно было изучить другие свойства новооткрытого белка. Добавив его в культуру стволовых клеток бластемы, ученые обнаружили, что nAG резко ускоряет их деление. Это означало, что ученые на верном пути и что белок nAG может иметь прямое отношение к регенерации.
На следующем этапе исследований обнаружилась связь белка nAG с нервами. Оказалось, что вскоре после ампутации конечности в дистальной части культи начинается активное производства белка nAG клетками, окружающими регенерирующий нерв (шванновскими клетками). Через некоторое время на поверхности бластемы образуется тонкий эпидермис с желёзками, и в этих желёзках тоже вырабатывается белок nAG.
Если же нерв был перерезан у основания (то есть убит), то после ампутации шванновские клетки не производят белка nAG, а бластема вскоре прекращает свое развитие и не образует железок.
Таким образом, стало ясно, что живой восстанавливающийся нерв необходим для того, чтобы шванновские клетки начали вырабатывать белок nAG. Теперь уже у ученых появились все основания предполагать, что белок nAG играет какую-то роль в передаче «руководящего сигнала» от нерва к клеткам бластемы (а принимается этот сигнал белком Prod 1).
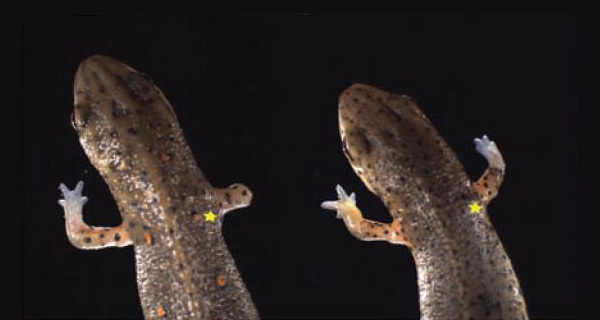
Если бы опыты ставились не на тритонах, а на мышах, то в качестве следующего шага было бы естественно «выключить» ген, кодирующий белок nAG (у мышей его нет, но есть его гомологи — белки AG2 и AG3), и посмотреть, будет ли отрастать отрезанная конечность. Но у мышей конечности, как известно, не отрастают, а у тритонов исследователи пока не умеют так ловко отключать гены. Поэтому исследователи поступили иначе. Сначала они перерезали нескольким тритонам нервы, идущие к правой передней лапе. Потом ампутировали конечность. После этого половине тритонов в культю ввели активно работающий ген белка nAG при помощи метода электропорации. Второй половине тритонов, которая служила контролем, тем же способом вели неработающий фрагмент ДНК.
Результат превзошел все ожидания. У контрольных тритонов, естественно, регенерация не состоялась (поскольку нерв был убит). У основной группы животных, несмотря на отсутствие в культе живого нерва, конечность восстановилась полностью, включая даже пальцы. Синтез белка nAG в шванновских клетках так и не начался, но бластема тем не менее стала быстро делиться и образовала эпидермис с желёзками, и эти желёзки, как и положено, начали производить белок nAG. После этого восстановление конечности шло обычным путем.
|
Таким образом, белок nAG оказался ключевым звеном в передаче сигнала от нерва к клеткам бластемы. Стало ясно, что живой восстанавливающийся нерв нужен для того, чтобы стимулировать производство белка nAG шванновскими клетками. Это стимулирует деление клеток бластемы и образование эпидермиса с желёзками, которые в дальнейшем берут синтез белка nAG на себя.
Данное исследование представляет собой важный шаг в изучении механизмов регенерации, хотя, конечно, до полного понимания этого процесса еще очень далеко (примерно так же, как и до полного понимания механизмов онтогенеза).