|
Как известно, мембрана нейрона обладает потенциалом покоя — то есть в спокойном состоянии между ее внутренней и наружной частями существует разность потенциалов. Возникает она так.
Мембрана образована двумя слоями липидов. Молекула липида состоит из гидрофильной (то есть растворимой в воде) «головки» и гидрофобного (нерастворимого в воде) «хвоста». «Хвосты» повернуты внутрь липидного бислоя, а «головки» — наружу, поскольку снаружи велико содержание воды. В результате внутри мембраны появляется гидрофобная «начинка», и гидрофильные молекулы — например, ионы натрия, калия, кальция, хлора — не могут сквозь нее пройти.
Чтобы пропускать эти ионы, в мембране есть специальные «двери» — ионные каналы. Это крупные белки с порой в середине, пронизывающие мембрану насквозь. Пора внутри канала, по которой и проходят ионы, может быть открыта или закрыта в зависимости от определенных условий (некоторые каналы реагируют на изменение мембранного потенциала, другие — на присоединение к ним молекулы лиганда). Таким образом мембрана становится избирательно проницаема для ионов — то есть те или иные ионы могут проходить сквозь нее только тогда, когда клетке это нужно.
В результате возле наружной поверхности мембраны невозбужденного нейрона «толпятся» ионы натрия, кальция и хлора, а возле внутренней поверхности собираются ионы калия, фосфат- и сульфат-ионы, крупные органические анионы и так далее. Больше всего разница между внутренней и наружной концентрацией у ионов калия — она составляет 56 к одному. Если мы подставим эти цифры в уравнение Нернста, то получится, что разность потенциалов между внутренней и наружной частями мембраны должна быть примерно –90 мВ (милливольт). Другие ионы (прежде всего — ионы натрия, кальция и хлора) тоже вносят свой вклад в появление потенциала покоя, и поэтому эта цифра уменьшается до –70 мВ.
Когда через синапс передается нервный импульс, на постсинаптическую мембрану попадает некоторое количество нейромедиатора (также о механизме работы синапсов см.: Проясняется механизм формирования синапсов, «Элементы», 22.06.2010). Молекулы медиатора «садятся» на соответствующие рецепторы. Эти рецепторы могут сами быть ионными каналами либо воздействовать на каналы через цепочку посредников. В любом случае, медиатор так или иначе действует на каналы, они открываются (или, наоборот, закрываются), сквозь них начинаются (или, наоборот, прекращаются) ионные токи, и мембранный потенциал меняется — возникает постсинаптический потенциал (ПСП).
|
В зависимости от того, деполяризовалась ли мембрана или, наоборот, гиперполяризовалась, этот потенциал называется возбудительным (ВПСП) или тормозным (ТПСП). Величина ПСП зависит от площади синапса, от того, сколько медиатора попало на постсинаптическую мембрану и сколько рецепторов на ней было. ПСП возникают локально в месте синапса, распространяются по мембране на некоторое расстояние и через какое-то время затухают. Между этими потенциалами существует пространственная и временная суммация — например, два возбудительных потенциала в соседних участках мембраны «сольются» в один потенциал большей силы, а возбудительный и тормозный потенциалы, наоборот, «погасят» друг друга. А поскольку импульсы по синапсам приходят постоянно, заряд мембраны нейрона в разных участках постоянно меняется на некоторую небольшую величину (как будто море, по которому постоянно ходят небольшие волны).
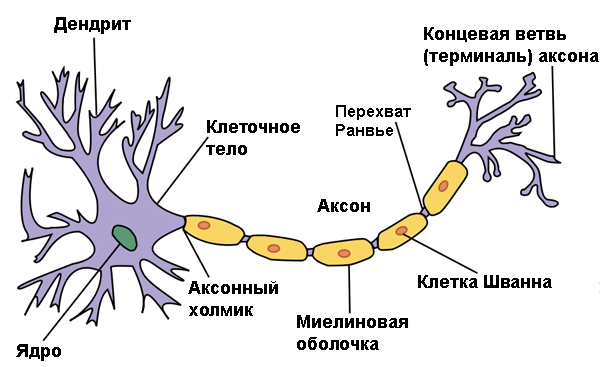
Особенное значение при суммации ПСП имеет один участок мембраны нервной клетки — аксонный холмик (см. Axon hillock), который переходит в инициальный сегмент аксона (ИСА). Если возбуждение здесь перейдет некую пороговую величину, произойдет генерация потенциала действия, и по аксону побежит нервный импульс. В мембране этой области находится большое количество ионных каналов различных типов, благодаря чему она становится особенно «чуткой». Большое значение имеет длина и местоположение ИСА в аксоне — ведь от этого зависит возбудимость нейрона.
У нейронов разных типов (и даже у представителей одного типа) положение ИСА сильно отличается. Однако каковы механизмы, «сдвигающие» ИСА вдоль аксона дистально (то есть вдаль от тела нейрона) или, наоборот, проксимально (ближе к телу клетки) было абсолютно неизвестно.
|
Нейробиологам из Лондонского Королевского колледжа удалось немного разобраться в этом вопросе.
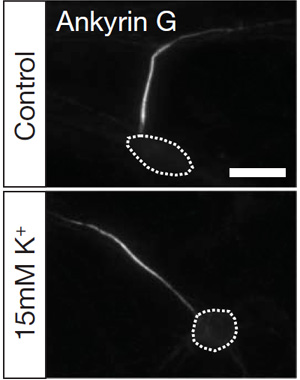
Они подвергали диссоциированные культуры гиппокампальных нейронов хроническому возбуждению, поместив их в среду с высоким содержанием калия (в такой среде соотношение концентраций калия внутри и снаружи становится меньше, и мембрана деполяризуется). Через несколько дней ученые посмотрели на локализацию характерных для ИСА белков, чтобы выяснить, где в этих клетках находится ИСА. Оказалось, что ИСА у опытных клеток по сравнению с контрольными сильно сдвигается вдоль аксона прочь от тела клетки. Это перемещение начинает проявляться после 5-7 дней культивации, почти сразу после начала формирования ИСА.
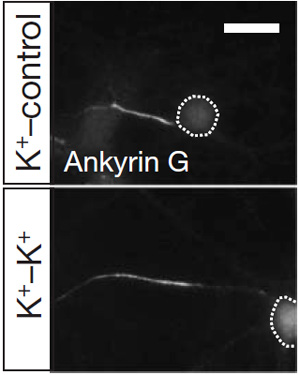
Если же прекратить хроническую деполяризацию, вернув нейроны в среду с нормальным содержанием калия, ИСА через некоторое время сдвигается обратно, ближе к телу клетки. Иными словами, нейроны «чутки» и к повышению, и к понижению уровня активности и реагируют на это «путешествиями» ИСА.
Надо отметить, что у возбудительных нейронов ИСА сдвигался гораздо сильнее, чем у тормозных; возможно, эти результаты пригодятся при исследовании эпилепсии.
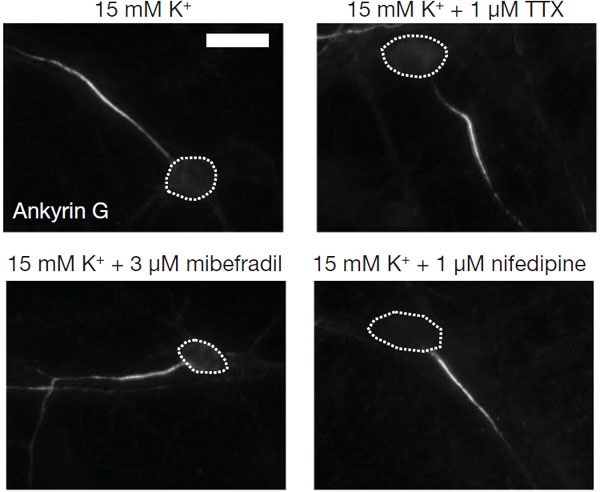
Хорошо, но каков же механизм, с помощью которого двигается ИСА? Ученые попробовали понять это, блокируя различные типы ионных каналов, встречающиеся в этой области. И вот выяснилось, что при блокировке двух типов кальциевых каналов ИСА перестает «путешествовать», несмотря на хроническую деполяризацию нейронов. То есть эти каналы явно замешаны в процессе передвижения ИСА, хотя точный механизм, по которому они работают, еще только предстоит исследовать.
|
Теперь оставалось только понять, на что влияют «путешествия» ИСА и какие последствия они могут иметь для нейронов. Исследования показали, что чем дальше находится ИСА от тела клетки, тем выше порог возбуждения для этого нейрона — то есть тем сильнее надо деполяризовать мембрану для того, чтобы нейрон отправил импульс по аксону. Иными словами, от местоположения ИСА напрямую зависит возбудимость нейрона. Получается, что передвижения этого участка — это такой вид пластичности, позволяющий нейрону оптимально подстроить свои характеристики под конкретные условия, не «перевозбудиться», но и не пропустить важные сигналы.
Вполне возможно, что полученные данные будут полезны для лечения болезней, при которых нарушается баланс между возбуждением и торможением в нервной системе, например эпилепсии.